
图片来源:Cell(DOI: https://doi org/10.1016/j.cell.2018.05.013)
5月31日,发表在Cell杂志上题为“Genetic Inactivation of CD33 in Hematopoietic Stem Cells to Enable CAR T Cell Immunotherapy for Acute Myeloid Leukemia”的这项研究中,宾夕法尼亚大学医学院的Saar Gill博士以及美国国立卫生研究院的 Cynthia E. Dunbar博士带领的团队首创了一种用CAR-T细胞治疗急性髓系白血病(Acute Myeloid Leukemia,AML)的新方法。
AML是第二常见的白血病类型,许多病人将接受骨髓移植。几年前,为了治疗急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),Carl H. June教授等开发出了一种靶向CD19的CAR-T疗法,并在去年获得了FDA的批准。然而,CD19并不是AML的有效靶点,因为这类癌细胞并不表达该分子。因此,科学家们一直在寻找其他适用于AML的潜在靶点。

IrvineNIST
最终,一个名为CD33的蛋白让他们看到了希望。遗憾的是,先前的尝试发现,靶向CD33的CAR-T细胞也会损伤健康细胞,因为该蛋白也在健康细胞中表达。虽然对健康细胞的损伤可以通过缩短CAR-T细胞的持续时间来预防,但这种方法违背了CAR-T疗法最大的优势——可在患者体内持续存在多年以防止病情复发。
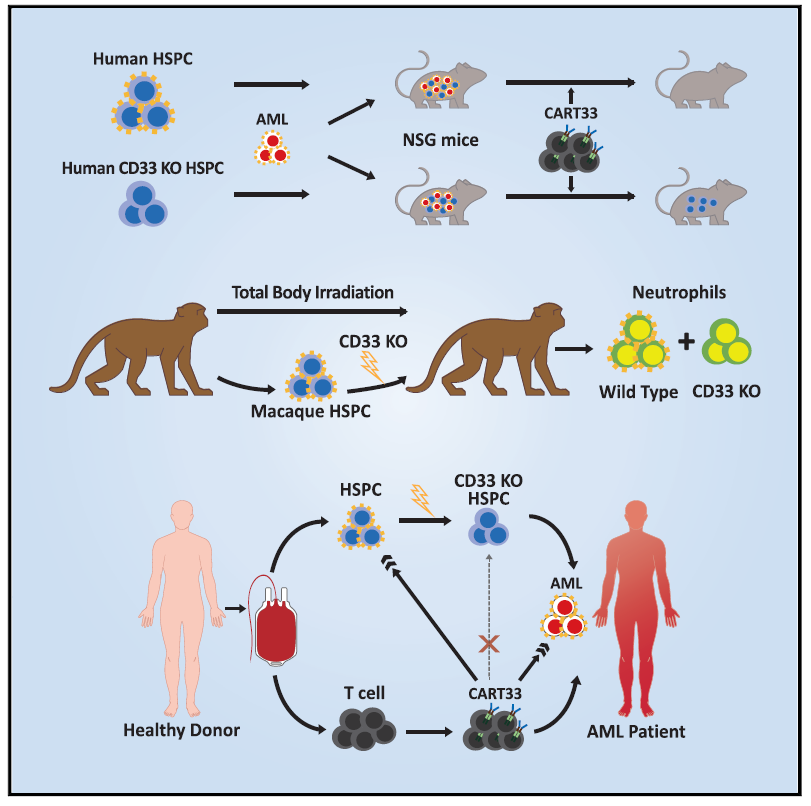
那么,如何让靶向CD33的CAR-T细胞既能攻击癌细胞,又能避免损伤健康细胞呢?科学家们想到了基因编辑工具CRISPR/Cas9。
图片来源:Cell
具体来说,Gill博士等发明的新方法借助这一“魔剪”去除了健康的造血干细胞(blood-forming stem cells)中的CD33,使得癌细胞成为了“CD33搜寻细胞”(CD33 hunter cell,即靶向CD33的CAR-T细胞)唯一能够攻击的目标。非常重要的是,他们惊喜的发现,缺乏CD33的健康干细胞也能正常发挥功能。如此一来,靶向CD33的CAR-T疗法既能发挥抗癌作用,又不会损伤健康细胞了。
Gill博士说:“除了脑癌中的EGFRvIII,现有的CAR-T疗法没有一种是针对癌症特异性抗原的(也就是说通常CAR-T细胞所针对的癌细胞抗原也会在健康细胞中表达),但利用该研究中提出的新方法,我们能够人为地‘创造’出癌症特异性抗原,从而释放CAR-T细胞最大的抗癌力量。我们可以将这种方法看作是2.0版(下一代)的骨髓移植,它不仅赋予了CAR-T细胞超强的抗白血病能力,同时还解决了主要的毒性问题。”
Dunbar博士认为,这一研究是有关CAR-T疗法治疗白血病有效性和安全性的一项重要进展。目前,他们已经在小鼠和猴子模型中证明了该方法是有效的,也在实验室环境中证实了这一方法对人类细胞的影响。接下来,该团队将在宾夕法尼亚大学开展人体试验。
 021-54720761
021-54720761
点我QQ咨询
点我QQ咨询
021-54720761
021-54720761
点我QQ咨询
点我QQ咨询