英文名称 :ATP Content Assay Kit(WST-1 Method)
产品包装 :盒装
产品规格 :50T/48S
储存条件 :-20℃
检测方法 :可见分光光度法
有 效 期 :6个月
产品组成:
|
试剂名称
|
规格
|
保存条件
|
|
提取液
|
液体 60 mL×1 瓶
|
2-8℃保存
|
|
试剂一
|
液体 45 mL×1 瓶
|
2-8℃保存
|
|
试剂二
|
粉剂×1 瓶
|
2-8℃保存
|
|
试剂三
|
液体 8 mL×1 瓶
|
2-8℃保存
|
|
试剂四
|
粉剂×3 支
|
-20℃保存
|
|
试剂五
|
粉剂×1 瓶
|
2-8℃保存
|
|
试剂六
|
粉剂×3 支
|
-20℃保存
|
|
试剂七
|
液体 12 mL×1 瓶
|
2-8℃保存
|
|
标准品
|
粉剂×1 支
|
-20℃保存
|
溶液的配制:
1.提取液:低温条件下,可能有结晶析出, 放于 60℃水浴加热溶解即可, 不影响使用;
2.试剂二:临用前加入 7 mL 蒸馏水充分溶解,可加热促进溶解, 用不完的试剂 2-8℃保存 4 周;
3.试剂四:临用前取 1支加入0.2mL蒸馏水溶解,用不完的试剂-20℃分装保存 2 周, 避免反复冻融;
4.试剂五:临用前加入3.2 mL蒸馏水充分溶解,用不完的试剂-20℃分装保存 4 周,避免反复冻融;
5.试剂六:临用前取 1 支加入 0.25 mL 蒸馏水备用, 用不完的试剂-20℃分装保存 2 周,避免反复冻融;
6. 标准品:5 mg ATP。临用前加入 0.826 mL 蒸馏水配成10μmol/mL的ATP标准溶液,用不完的试剂-20℃ 分装保存 4 周, 避免反复冻融;
7. 0.3125μmol/mL 标准溶液的配制:临用前吸取 20μL 10 μmol/mL 的ATP标准溶液和620μL蒸馏水混合配制成 0.3125μmol/mL 标准溶液,用于标准管的测定;
8. 工作液的配制: 临用前请按试剂二: 试剂三: 试剂四:试剂五: 试剂六=1mL:1mL:0.1mL:0.4mL:0.1mL 的比例配制(2.6mL,约 10T 的量),现配现用。
产品简介 :TP广泛存在于动物、植物、微生物和培养细胞中,是生物能量通货,能荷是描述细胞能量代谢状态的主要参数。测定ATP含量并且计算能荷,能够反映能量代谢状态。
HK催化葡萄糖和ATP合成6-磷酸葡萄糖,6-磷酸葡萄糖脱氢酶进一步催化6-磷酸葡萄糖脱氢生成NADPH,WST-1可与NADPH 反应,产生水溶性 formazan,在450nm下有特征吸收峰。
注意:实验之前建议选择 2-3 个预期差异大的样本做预实验。如果样本吸光值不在测量范围内建议稀释或者 增加样本量进行检测。
需自备的仪器和用品:
可见分光光度计、水浴锅/恒温培养箱、低温离心机、可调式移液枪、1mL 玻璃比色皿、研钵/匀浆器/超声波 细胞破碎仪、蒸馏水、冰和氯仿。
操作步骤:
一、样本处理(可适当调整待测样本量)
1 、血清(浆)中 ATP的提取:按照血清(浆)体积(mL):提取液体积(mL)为 1:5~10的比例(建议取约 0.1mL 血清(浆),加入1mL提取液)混合, 充分震荡,10000g,4℃离心10min;取上清液至另一EP管中,加入 500μL的氯仿充分震荡混匀,10000g 4℃离心 3min,取上清, 置冰上待测(不可用于蛋白质含量测定)。
2 、组织中 ATP 的提取: 按照组织质量(g):提取液体积(mL)为 1:5~10的比例(建议称取约 0.1g 组织,加入1mL提取液),进行冰浴匀浆,10000g 4℃离心10min,取上清至另一EP 管中,加入 500μL 的氯仿充分震荡 混匀,10000g 4℃离心 3min,取上清,置冰上待测(不可用于蛋白质含量测定)。
3 、细胞或细菌中 ATP 的提取:先收集细胞或细菌到离心管内,弃上清,按照细菌或细胞数量(10⁴个):提取液 体积(mL)为 500~1000:1 的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎(冰浴,功率 200W,超声 2s,停 1s,总时间 1min), 10000g 4℃离心 10min;取上清液至另一EP 管中,加入500μL的氯仿充分震荡混匀,10000g 4℃离心 3min,取上清, 置冰上待测(不可用于蛋白质含量测定)。
注:以上提取过程严格控制在冰浴条件下进行。
二、测定步骤
1 、可见分光光度计预热30min以上,调节波长到450nm,蒸馏水调零。
2 、试剂一置于37℃水浴锅/恒温培养箱中预热15min以上。
3 、操作表:(按下表在1.5mLEP管中加入相应试剂)
|
试剂名称(μL)
|
测定管
|
标准管
|
空白管
|
|
样本
|
100
|
-
|
-
|
|
标准溶液
|
-
|
100
|
-
|
|
蒸馏水
|
-
|
-
|
100
|
|
试剂一
|
650
|
650
|
650
|
|
工作液
|
250
|
250
|
250
|
|
混匀, 置于 37℃水浴锅/恒温培养箱中培养 1h
|
|
试剂七
|
150
|
150
|
150
|
充分混匀,于1mL玻璃比色皿测定 450nm 处的吸光值,记为A测定、A 标准、A空白,计算ΔA测定=A测定-A空白,ΔA标准=A标准-A空白(空白管和标准管只需做1-2次)。
三、 ATP 含量计算
1. 血清(浆)中ATP含量计算
ATP含量(μmol/mL) = C 标准×ΔA 测定÷ΔA 标准×(V 提取+V 血清(浆)÷V 血清(浆) = 3.4375×ΔA 测定÷ΔA 标准
2. 按样本质量计算
ATP含量(μmol/g 质量)= C标准×ΔA测定÷ΔA 标准×V提取÷W =0.3125×ΔA 测定÷ΔA 标准÷W
3. 按蛋白浓度计算:
ATP含量(μmol/mg prot)= C 标准×ΔA 测定÷ΔA 标准×V 样本÷(V样本×Cpr)=0.3125×ΔA 测定÷ΔA 标准÷Cpr
4. 按细菌或细胞数量计算
ATP含量(μmol/10⁴cell)= C 标准×ΔA测定÷ΔA标准×V提取÷N = 0.3125×ΔA测定÷ΔA标准÷N
C 标准:标准溶液浓度,0.3125μmol/mL;V 提取:加入的提取液体积,1mL;V 血清(浆):血清(浆)体积, 0.1mL;V样本:反应体系中加入的样本体积,0.1mL;W:样本质量,g;Cpr:样本蛋白浓度,mg/mL;N:细胞或细菌总数,按10⁴个。
注意事项:
1、加入提取液离心后的上清若为浑浊为正常现象。
2、如果 ΔA 测定>1.5,建议将样本用蒸馏水稀释后进行测定。注意计算公式中乘以稀释倍数;如果吸光值过低 或接近空白,建议统一放置于 37℃水浴锅/恒温培养箱中培养2h或更长时间后再次测定, 也可以加大样本量后进 行测定,注意同步修改计算公式。
3、提取液中含蛋白变性成分,若按蛋白浓度计算需要另取样本重新计算。
实验实例:
1 、取0.108g小鼠脑加入1mL提取液进行冰浴匀浆,10000g 4℃离心10min,取上清至另一EP 管中,加入500μL的氯仿充分震荡混匀,10000g 4℃离心3min,取上清,置冰上按照测定步骤操作,使用1mL玻璃比色皿测得计算ΔA测定=0.283-0.154=0.129 ,ΔA标准=A标准-A空白=0.569-0.154=0.415,按样本质量计算含量得:ATP含量(μmol/g质量)=0.3125×ΔA测定÷ΔA 标准÷W=0.899μmol/g 质量。
2 、取 0.111g绿萝叶片加入1mL提取液进行冰浴匀浆,10000g 4℃离心10min,取上清至另一EP管中,加入500μL的氯仿充分震荡混匀,10000g 4℃离心3min,取上清,置冰上按照测定步骤操作,使用1mL玻璃比色皿测得计算ΔA测定=0.387-0.154=0.233 ,ΔA标准=A标准-A 空白=0.569-0.154=0.415,按样本质量计算含量得:ATP含量(μmol/g 质量)=0.3125×ΔA测定÷ΔA 标准÷W=1.58μmol/g质量。

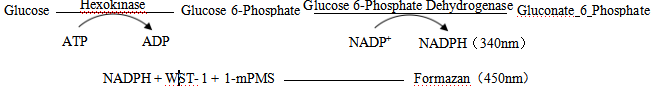
 021-54720761
021-54720761
点我QQ咨询
点我QQ咨询
021-54720761
021-54720761
点我QQ咨询
点我QQ咨询